TDMの基礎知識
TDMの基礎知識
TDMとは治療効果や副作用に関する様々な因子をモニタリングしながらそれぞれの患者に個別化した薬物投与を行うことです。多くの場合、血中濃度が測定され、臨床所見と対比しながら投与計画が立てられます。薬物を投与する際には期待する効果とそうでない効果(副作用)が現れますが、それらが薬物の血中濃度と相関する場合に血中濃度を指標として投与法を決定するわけです。TDMが行われる薬物には一般的な指標として有効血中濃度が知られています。
例えば抗MRSA薬である塩酸バンコマイシンではMRSAのMICが考慮され、最低血中濃度が5μg/mL以上であることが必要ですが、最低血中濃度が15~20μg/mL以上になると腎機能障害などの副作用が生じやすくなるため、一般的には5~15μg/mLが有効血中濃度とされています。しかし個々の患者における薬物への反応性が異なるため、治療評価項目である細菌培養や発熱、炎症所見、また、副作用の評価項目である腎機能などを観察しながら投与を行います。薬物投与の際に治療目標の指標となる観察項目をモニタリングパラメータと呼んでいます。PK-PDパラメータやバイオマーカーもTDMのモニタリングパラメータとして利用されるようになり、治療の個別化はより最適化されるようになりました。
(木村利美)
- PK-PDパラメータとバイオマーカー
- コンパニオン診断薬
- 採血の留意点
- 薬物血中濃度が有用な場合
- TDMと薬物動態
- 分布容積 Vd と負荷投与量
- クリアランス CL と維持投与量
- 消失速度定数(Ke)、半減期(t1/2)と投与間隔決定
- 特定薬剤治療管理料(TDMの診療報酬)
- TDMと精度管理
- 薬物血中濃度測定法
- 専門用語解説
PK-PDパラメータとバイオマーカー
ここでPK-PDパラメータやバイオマーカーについて解説しておきます。
前述したようにTDMでは血中濃度を指標に投与設計を行うことが多いのですが、組織における受容体数の違いやその他の様々な因子によって、血液に存在する薬物量が同じでも組織における反応性は異なり、個人差を生じます。そのため、薬物の用量と血中濃度を紐付けるPK(Pharmacokinetics)モデルと作用部位における薬物濃度と効果を関係付けるPD(Pharmacodynamics)モデルを組み合わせたPK-PD解析によって、血中濃度の指標(PKパラメータ)と効果(PDパラメータ)との間にどのような関係があるのかを見つけることが必要です。例えば抗菌薬投与において同じ血中濃度であっても、菌のMICが異なれば抗菌薬暴露後の生菌数に差が生じるため、血中濃度から効果を予測するためにはMICによる補正が必要となるわけです。アミノ配糖体系の抗菌薬では、その殺菌効果はCmax/MICに相関することが知られ、Cmax/MICを指標とした投与設計が行われますが、Cmax/MIC比のように、PKとPDを関連付けるパラメータをPK-PDパラメータと呼びます。
臨床でよく使用されるのは抗菌薬のPK-PDパラメータでAUC/MIC、AUIC、t>MIC、Cmax/MIC(Cpeak/MIC)などがあります。AUC/MICは定常状態における総AUCのMICに対する比率で、血中濃度曲線下面積をMICで除した値です。AUICは定常状態におけるMIC以上の血中濃度曲線下から算出されたAUCのMICに対する比率で表されます。
AUC/MIC、AUICは定常状態における24時間値として算出されます。t>MIC(time above MIC)は定常状態において、MIC以上の濃度が維持される時間(t)の投与間隔に対する割合(%)を示します。Cmax/MIC(Cpeak/MIC)は定常状態におけるCmaxまた はCpeakに対するMICの比率です。
バイオマーカーは古くからある言葉ですが、ある意味その捕らえ方は様々です。FDAのFrameworkはバイオマーカーの位置づけをクリニカルエンドポイント等も含めて以下のように定義づけています。
A characteristic that is objectivelymeasured and evaluated as an indicator of normal biologic processes, pathogenic processes, or pharmacologic responses to a therapeutic intervention.
バイオマーカーとは生物学的プロセスや病理学的プロセス、あるいは治療に対する薬理学的な反応の指標として客観的に測定・評価される項目である。
Clinical Endpoint Definition; A characteristic or variable that reflects how a patientfeels, functions or survives (Note that, except for survival, all these involve some sort of intermediary measurement).
クリニカルエンドポイントはある種の仲介的な測定項目を含んでいるが、患者がどのように感じて、機能してあるいは生きてゆくかを反映する、最終的な目標となる指標であり、バイオマーカーはクリニカルエンドポイントを客観的に代替しようとする指標である。
A biomarker intended to substitute for a clinical endpoint. A surrogate endpoint is expected to predict clinical benefit (or harm, or lack of benefit) based on epidemiologic, therapeutic, pathophysiologic or other scientific evidence.例えばクリニカルエンドポイントが脳卒中の発生であった場合に、サロゲートエンドポイントとして測定される血圧は因果関係から推測されるものであって、必ずしもクリニカルエンドポイントの指標として客観的ではなく、臨床的なアウトカムに完全に相関しない場合があります。これらは言葉の定義に関する概念であり、同じ測定指標であっても、捉え方の違いによって指標の位置づけが異なってきます。
また、サロゲートエンドポイントは疫学的、治療学的、病態生理学的あるいは他の化学的な根拠に基づき、臨床的な有益・有害事象などクリニカルエンドポイントの発生予測を推定しようとする指標である。
臨床分野におけるバイオマーカーの具体的な例として心電図、PETの画像、血清化学物質、血液中の自己抗原、骨密度測定、肺機能試験、新生児のアプガースコアなどがあげられ、診断、病期分類、病態指標、介入による臨床反応のモニターや予測など に使用されています。
近年、ゲノム解析やプロテオーム解析が進んできたことによって、DNAやRNA、生体蛋白等に関連したさまざまなバイオマーカーが見出され、遺伝子診断等に基づいた治療の個別化にも利用されています。CYP2C9や2C19、2D6などの薬物代謝酵素の遺伝子 多型はTDM領域でも利用されるバイオマーカーの一つです。抗てんかん薬のフェニトインは非線形性を来たす薬物で一定濃度を超えると急激に血中濃度が上昇しますが、本剤はCYP2C9や2C19の変異株により血中濃度上昇が見られるため特に注意が必要で す。グルクロン酸抱合に関与するUGT1A1などは、抗がん剤の副作用を予測するためにSNPs(一塩基変異多型)解析のキットとして製品化されています。重篤な下痢を起こし死亡例も報告されているカンプトテシンなどに使用されます。
従来の血中濃度モニタリングに加え、PK-PDパラメータや分子レベルでのバイオマーカーを取り入れることで、TDMはより治療の個別化が図れるようになりました。
コンパニオン診断薬
コンパニオン診断薬とは、医薬品の臨床使用に際して用いられる体外診断薬で、医薬品のベネフィットが最も期待される患者を特定するもの、医薬品の重篤な有害事象のリスクが大きい患者を特定するもの、あるいは治療法最適化(治療スケジュール、用量、投与中止等)のために反応性をモニターするもの、などと定義1),2)されていて、新規の検査であれば、医薬品と対になって開発・承認される必要があります。ファーマコジェネティクス/ファーマコゲノミクス(PGx)とともに、個別化医療の一端を担うものとして注目されています。3),4)たとえば、クリゾチニブとALK融合遺伝子検出キットやモガムリズマブとCCR4キットなどがあります。
[参考資料]-
FDA CDRH: Guidance for Industry and Food and Drug Administration Staff - In Vitro Companion Diagnostic Devices
(DRAFT GUIDANCE)(Document issued on: July 14, 2011) -
個別化医療・コンパニオン診断薬をめぐる規制動向
医薬品・バイオ製品合同専門部会 資料3(平成25年1月30日) -
コンパニオン診断薬の現状と課題
製薬協政策研ニュース No.36(平成24年7月発行)
採血の留意点
薬物血中濃度を測定する際の採血は通常静脈採血です。点滴静注を行っている場合には、薬物が投与されているルート側と異なる体幹躯から採血を行います。点滴ルートからの採血はなるべく避け、採血が困難でルートからの血液採取を行う場合には、点滴ルート内に薬物の残留が無いように注意します。 採血管には血漿分離剤を使用しているものがありますが、分離剤に吸着される薬物もあるため、分離は速やかに行います。測定まで時間がかかる場合には冷所に保管し、当日測定できない場合には凍結保存とします。ほとんどの薬物は血清あるいは血漿濃度を用いて測定しますが、シクロスポリンは赤血球への薬物分布が多いため全血を用います。
採血時間のタイミングも重要なポイントです。効果を維持するためには一定の濃度を維持する必要があり、また濃度が上がり過ぎて副作用が起きないように、効果と副作用の確認のためにトラフ値(谷値とも呼ばれる投与直前値)を採血します。また、テオフィリンなど薬によってはピーク値に依存して副作用の起こるものがあり、副作用を確認する場合にピーク値を採血する薬がいくつか知られています。つまり個々の薬によって効果あるいは副作用・中毒の確認など、目的にあった採血時間が必要となります。但し、フェノバルビタールのように半減期が長く、一日の血中濃度の振れ幅が小さい場合にはどのタイミングで採血を行っても問題はありません。これらの概念に相当しないのがアミノ配糖体系の抗菌薬(ピーク値とトラフ値の2点採血)とメトトレキサート(24, 48, 72時間の経時採血)です。急を要しない場合は定常状態(半減期の3~4倍以上の時間)で採血を行います。
薬物血中濃度が有用な場合
薬物血中濃度が治療効果と副作用と密接に関連するとき、薬物血中濃度は投与設計の指標となる。 以下のような場合に、TDMは有用である。
-
薬効および副作用の測定が容易でない。-効果=患者に何も起きないこと
(例:シクロスポリン、タクロリムス、および抗てんかん薬) -
効果と耐性防止が期待できる。
(例:抗生物質、抗悪性腫瘍薬など) -
用量と血中濃度の関係において、個人内および個人間の変動が大きい。
(例:ジギタリス製剤および抗生物質など) -
用量と血中濃度の関係において、直線関係が成り立たない。
(例:フェニトイン、アプリンジン、テオフィリン服用患者の一部) -
疾患の急激な変化。-感染症、循環器疾患、悪性腫瘍の患者では注意。
(心機能、肝機能および腎機能の変化による薬物動態の変化) -
併用薬剤の変更による薬物血中濃度の変動が予想される。
(+シメチジン→テオフィリン(↑)、+フェニトイン→テオフィリン(↓)、など多数) -
代謝酵素の自己誘導による薬物動態の変化
(例:カルバマゼピン) - 患者が服用していないこと(noncompliance)が疑われる。
TDMと薬物動態
望ましい血中濃度が明らかなとき、血中濃度が高ければ投与量を減らし、低ければ投与量を増やすなどの試行錯誤の投与法の検討は、至適投与法を見いだすまでに時間がかかり、しかも効果が得られずに患者の病状が悪化したり、患者を副作用の危険にさらすこともあるため良い方法とはいえない。患者の薬物動態を推定し目標血中濃度となる投与法を決定することは有効かつ安全で効率的な方法である。
薬物動態推定には、薬物動態モデルを用いるが、多くの場合、身体をひとつの箱と考える1コンパートメントモデル(one compartment model)を使用する。そして、このモデルにおいて、分布容積(volume of distribution、略語はVd、通常単位はL)およびクリアランス(clearance、略語はCL。通常単位はL/hr)が基本パラメータである。
分布容積 Vd と負荷投与量
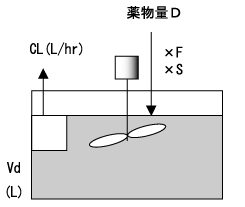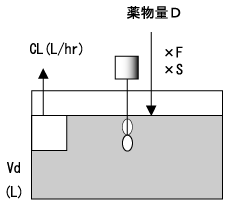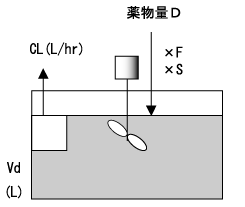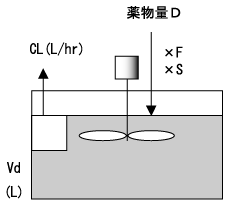
ある薬物を急速静脈または経口で投与する場合を考える。但し、経口投与の場合、薬物の吸収速度は極めて速く、経口投与後の血中濃度推移が急速静脈投与後の血中濃度推移に近似できるものとする。
初めて投与量D(mg)を投与するとき、投与直後の薬物血中濃度(mg/L)は、体循環に到達する活性型薬物量であるD×F×S(mg)とVd(L)の比になる。すなわち、図2において、水槽の薬物濃度は、水槽に入れた薬物量と水の容積で決まる。
ここで、Fは生物学的利用率(bioavailability)で、消化管から吸収され代謝を免れて体循環に到達する薬物の割合である。また、Sは塩係数(salt form)と呼ばれる活性型薬物の割合である。
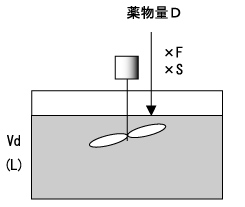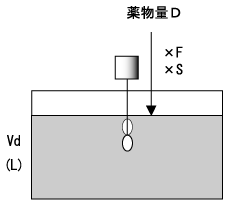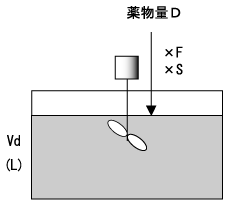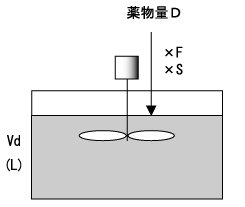
Dの投与によって増加する濃度ΔCpは式1で表される。そして、VdはDとΔCpから式2を用いて計算できる。
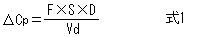
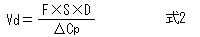
式1をDについて整理し、ΔCpの代わりに目標濃度Cp targetを用いることによって、速やかに目標血中濃度に到達させるための投与量(負荷投与量、Loading Dose)を計算することができる。
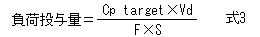
クリアランス CL と維持投与量
薬物量Dを投与してΔCpの濃度が増加したあと、もし追加投与を行わなければ、薬物は腎臓、肝臓などから排泄され体外に除去されるため、薬物血中濃度は時間経過とともに低下する。CL(通常単位はL/hr)は薬物の除去能力であり、薬物で汚染されたVdが単位時間あたりどれくらい浄化されるかを表す(図3)。
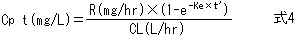
さらに時間が経過し、t’が半減期の5倍以上になると、投与速度Rと除去能力CLがほぼ釣り合って薬物血中濃度は一定となる(図4)。この状態を、定常状態(steady state)という。
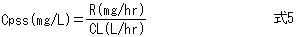
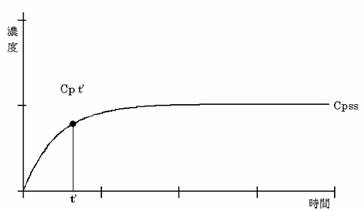
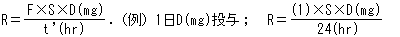
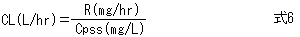
負荷投与量は目標濃度にVdを掛けて求め、維持投与量は目標濃度にCLを掛けて求める。
消失速度定数(Ke)、半減期(t1/2)と投与間隔決定
CLとVdの比は消失速度Keである。

生物学的半減期(以下、半減期と呼ぶ。略語t1/2)は、次式により求める。
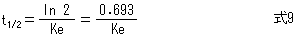
生物学的半減期を用いて投与間隔を決定する薬物としてアミノグリコシド系抗生物質がある。たとえば、ゲンタマイシンは、緑膿菌を含むグラム陰性桿菌に有効なアミノグリコシド系抗生物質であるが、ピーク濃度を最小発育阻止濃度(MIC)の10倍以上とし、トラフ濃度をできるだけ低くすることによって、治療効果がより確実に得られ、かつ聴器障害および腎障害などの副作用を避けることができる。
ゲンタマイシンの目標ピークを8mg/Lとすると、2半減期以上経過しないと2mg/Lまで低下しない。たとえば、t1/2が3時間のときは6時間以上経過することが必要であり、実際には点滴時間および2mg/L未満となるように時間的余裕を考慮して8時間毎に投与する。つまり、ピークとトラフの両方に目標濃度がある薬物の投与間隔は、Keおよびt1/2がわかれば決定することができる。
特定薬剤治療管理料(TDMの診療報酬)
昭和55年に躁うつ病治療剤である炭酸リチウム、次いで翌56年に抗てんかん剤とジギタリス製剤について、血中濃度をモニタリングし治療に役立てること、すなわちTDMが保険点数化された。以降、TDMの治療面での有用性が確認されるとともに、対象薬剤も漸次拡大され、点数も引き上げられてきた。医療費抑制が国の最重要課題となり、低減化・包括化が推進されている中にあって、このTDMに関する「特定薬剤治療管理料」が拡充されていることの意義は大きく、真摯に受け止めなければならない。
一方、簡便な測定機器の開発などもあり、中小規模の施設や調剤薬局等での測定も可能になったことは大変に喜ばしい。しかしながら、全体としての普及率の低さに加え、血中濃度測定のみにとどまり、解析による患者背景を考慮したコメント提供などは極めて低率なのが現状である。医療の質向上と経済効果、この双方への寄与について、広範に検証されなければならない。
特定薬剤治療管理料の算定は複雑であり、改変も多いことから、その都度の確認が必要である。以下、算定に関わる主な要件・注解および対象薬剤名を記載する。
- 投与薬剤の血中濃度を測定し、その結果に基づき当該薬剤の投与量を精密に管理した場合、同一暦月に1回に限り算定し、保険請求できる。
- 本管理料には、薬剤の血中濃度測定、当該血中濃度測定に係る採血及び測定結果に基づく投与量の管理に係る費用が含まれるものであり、1月のうちに 2回以上血中濃度を測定した場合であっても、それに係る費用は別に算定できない。
- 薬剤の血中濃度、治療計画の要点を診療録に記載する。
- 管理料は、抗不整脈薬については患者に薬剤を継続的に投与した場合、アミノ配糖体抗生物質については数日間以上投与している入院患者の場合に算定できる。
- ジギタリス製剤の急速飽和とは、2日間程度のうちに数回ジギタリス製剤を投与し治療効果が得られる濃度までに到達する場合をいう。なお、当該算定を行った急速飽和完了日の属する月においては、別に特定薬剤治療管理料は算定できない。
- てんかん重積状態のうち算定の対象になるものは、全身性けいれん発作重積状態で、注射薬剤等の血中濃度を測定し、その結果をもとに投与量を精密に管理した場合をいう。なお、その状態消失日の月には別に特定薬剤治療管理料は算定できない。
- 対象薬物には、不整脈用剤やメトトレキサートのように個々の薬物名が特定されているものと、ジギタリス製剤や抗てんかん剤のように個々の薬物名が特定されていないものがあることを認識しておく必要がある
| 対象薬物名 (測定薬物・代謝物名) | |
|---|---|
| ジギタリス製剤 | ジギトキシン ジゴキシン |
| テオフィリン製剤 (アミノフィリンを含む) |
テオフィリン |
| 不整脈用剤 | アプリンジン、アミオダロン(活性代謝物モノデスエチルアミオダロン)、キニジン、ジソピラミド、シベンゾリン、ソタロール**、ピルジカイニド、ピルメノール、フレカイニド、プロカインアミド(活性代謝物N-アセチルプロカインアミド)、プロパフェノン、ベプリジル**、メキシレチン、リドカイン |
| 抗てんかん剤# | エトスクシミド、ガバペンチン、カルバマゼピン、クロナゼパム、クロバザム、ゾニサミド、トピラマート、ニトラゼパム、バルプロ酸、フェニトイン(ホスフェニトイン***)、フェノバルビタール、プリミドン、ラモトリギン、レベチラセタム |
| アミノ配糖体抗生物質 | アミカシン、アルベカシン、ゲンタマイシン、トブラマイシン |
| グリコペプチド系抗生物質 | テイコプラニン、バンコマイシン |
| トリアゾール系抗真菌剤 | ボリコナゾール* |
| 免疫抑制剤 | エベロリムス**、シクロスポリン、タクロリムス、ミコフェノール酸** |
| サリチル酸系製剤 | サリチル酸 |
| 抗悪性腫瘍剤 | イマチニブ**、メトトレキサート |
| ハロペリドール製剤 | ハロペリドール |
| ブロムペリドール製剤 | ブロムペリドール |
| リチウム製剤 | リチウム |
** 平成24年4月収載
*** フェニトインのプロドラッグ
# 参考:TDM研究 2013:30(2), 53~108
「TDM実践ハンドブック」
2007年6月(株)薬事新報社)
2013年5月 一覧表改訂)
TDMと精度管理
近年の臨床検査技術の進歩で、さまざまな測定技術や測定法が出現している。そして、その測定法は血中薬物濃度測定分野にも及んで、汎用機器であらゆる分野の項目測定が可能になってきた。
そのような状況の中で、狭い有効域である血中薬物濃度測定値の信頼性を高めるには、今まで以上に精度管理を行う必要性が非常に高くなっている。
精度管理には、外部精度管理(コントロールサーベイ)と内部精度管理があり、それぞれ次のような目的で行われている。
-
目的:自施設の測定に関する問題点を見つけ、測定方法や測定手技を改善する為に、相対的評価を行う。
- 試料:
- 市販のコントロール血清
複数のTDM対象薬剤が添加された製品 - 調製検体(Spiked Sample)
- 薬剤が投与された患者検体(Patient Sample)
- 市販のコントロール血清
-
目的:日常測定において測定値の正確性を保証し、施設内の測定誤差を管理する。
- 試料:
- 市販のコントロール血清
市販の試薬キット専用コントロール血清または複数のTDM対象薬剤が添加された製品 - 調製検体(Spiked Sample)
- 薬剤が投与された患者検体(Patient Sample)
- 市販のコントロール血清
- 管理法:X-R管理図にて管理する
精度管理の目的は、ばらつきや正確度のずれの原因をつきとめ、それを改善することである。そのためには、問題点を効率良く把握できるような体制、そして、所定の精度が得られるような環境作りが必要である。
「TDM実践ハンドブック」
2007年6月(株)薬事新報社)
薬物血中濃度測定法
血中濃度測定に広く用いられている免疫学的測定法の市販キットは、簡便・迅速かつ効率的に測定できる方法である。しかし、TDM対象の抗不整脈薬のうち、約半数の薬の血中濃度測定は、市販キットがないため、HPLCなどの分離分析法によって行う必要がある。一方、測定装置をもたない医療機関でも民間の検査センターを利用して血中濃度測定を行うことが可能である。検査センターによる測定では結果が得られるまでの時間の短縮が課題であったが、翌日の昼頃までに結果を FAX で報告するサービスを提供している検査センターもあり、投与法の変更に利用できる迅速性が得られる。
- 免疫学的測定法測定薬剤に対する抗体を使用した測定法である。EMITなど汎用機に適応できる測定法と、FPIA、ELISAなどのように専用機が必要な測定法がある。特殊な技術を必要としない簡便・迅速な測定法であり、TDMの普及に果たす役割は大きい。一方、生体内物質、代謝物、併用薬剤などとの抗体の交差反応性に注意する必要がある。
- 放射性免疫測定法(RIA)
放射性廃棄物が出るため、現在ではあまり使用されなくなった。 - 非放射性免疫測定法
- 酵素免疫測定法(EIA)
各社が試薬キットを提供している。 - 蛍光偏光免疫測定法(FPIA)
血中濃度測定用の試薬キットの種類が多い。 - ホモジニアスEIA法(EMIT法など)
臨床検査用の汎用機器を用いて血中濃度の測定を行うことができる。 - 競合蛍光免疫測定法(CFIA)
- 化学発光免疫測定法(CLIA)
FPIAの後継測定法として、薬物濃度測定用試薬の開発が進んでいる。 - ヘテロジニアスEIA法(ELISA)
- イムノクロマト法
- ラテックス凝集阻害法(PENTINA)
- 酵素免疫測定法(EIA)
- 放射性免疫測定法(RIA)
- 分離分析法
- ガスクロマトグラフィー
気化させる必要があるため、測定できる薬は限られるが、専用分析カラムによる複数の抗てんかん薬の同時定量法が利用できる。 - 高速液体クロマトグラフィー(HPLC法)
汎用性が高い分析法である。市販キットが利用できない薬の血中濃度測定に利用されている。検体に由来する妨害ピークを除去するために、有機溶媒抽出または固相カラム抽出など、前処理を行うことが必要である。一般に測定には、可視紫外部検出器が用いられるが、薬によっては蛍光検出器など他の検出器を用いることもある。 - LC/MS/MS
簡単な前処理操作で、薬物血中濃度を精度良く測定できる物理化学的測定法として注目されており、免疫抑制薬の測定などに応用されている。
- ガスクロマトグラフィー
- その他の分析法
-
リチウムの血中濃度測定には以下の測定法が使用される。
- 原子吸光分析法
- 炎光法
- 電極法
- 比色法
- 原子吸光分析法